пароксизмальные формы активности мозга это
ЭЭГ в психиатрии и неврологии
ЭЭГ является чрезвычайно чувствительным вольтметром. Типичные сигналы ЭЭГ колеблятся в широком диапазоне. Электрические потенциалы, измеренные между любыми двумя электродами ЭЭГ, колеблются быстро, обычно много раз в секунду. Эти сигналы ЭЭГ являются результатом суммарных потенциалов поля, генерируемых возбуждающими и ингибирующими постсинаптическими потенциалами в вертикально ориентированных пирамидальных клетках коры.
На ЭЭГ бодрствующего и расслабленного здорового взрослого человека обычно преобладают частоты от 8 до 13 колебаний в секунду (альфа-активность от 8 до 13 Гц). Как только человек сосредотачивает на чем-то свое внимание или испытывает стресс, частота увеличивается до диапазона бета (выше 13 Гц). Когда взрослый начинает испытывать чувство сонливости, ритмы ЭЭГ замедляются до диапазона тета (от 4 до 8 Гц) и, наконец, до диапазона дельта (ниже 4 Гц) во время сна. Появление высокоамплитудной теты или любой дельты во время бодрствования является определенной патологией. Чрезмерная бета-активность во время бодрствования связана с тревожными расстройствами, она не считается аномалией ЭЭГ (по современным стандартам) и не может использоваться для диагностики тревожных состояний.
Чаще всего на ЭЭГ выявляется два типа отклонений : замедление нормальных ритмов и появление аномальной пароксизмальной (эпизодической) электрической активности, наводящей на мысль об эпилептическом процессе. Оба вида аномалий могут быть очаговыми и наводить на мысль о локализованном патологическом процессе, или генерализованными и более рассеянными, наводить на мысль о дегенеративном или метаболическом процессе. Если есть подозрение на замедление, пациент должен бодрствовать во время записи ЭЭГ; если подозревается пароксизмальная активность, ЭЭГ необходимо проводить как во время сна, так и в период бодрствования.
Пограничное расстройство личности
Исследования показали, что у пациентов с пограничным расстройством личности частота достоверных и менее выраженных нарушений ЭЭГ значительно выше, чем у пациентов с дистимическим расстройством. Аномалии (в основном замедление активности коры) чаще всего были двусторонними и имели фронтальное, височное или лобно-височное распределение. Было обнаружено, что у пациентов с пограничным расстройством личности наблюдается гораздо более высокая распространенность симптомов, обычно наблюдаемых при сложных парциальных припадках или эпизодической потери контроля, чем у пациентов с униполярной депрессией. Точно так же у пациентов с пограничным расстройством личности распространенность пароксизмальной ЭЭГ-активности была значительно выше, особенно, проявляясь в виде острых задних волнах (что указывает на эпилептический профиль).
Расстройства аутистического спектра
Эпилепсия часто встречается у детей с расстройствами аутистического спектра (ASD). У значительной части детей с аутизмом наблюдаются аномальные ЭЭГ, даже у тех, у кого никогда не было судорожного припадка. Нарушения ЭЭГ могут варьироваться от умеренных медленных аномалий до откровенных эпилептиформных разрядов (эпилептиформные разряды могут быть обнаружены только во время сна и иногда могут потребовать длительного наблюдения).
Вопрос о том, оказывает ли терапевтическое лечение на устранения пиков ЭЭГ и на психопатологическую симптоматику у детей с распространенными нарушениями развития и аутизмом, остается открытым.
Наиболее распространенным психическим расстройством, которое следует отличать от эпилепсии височной доли, является паническое расстройство. Здесь судороги были более короткими и более стереотипными, чем приступы паники. Кроме того, афазия и дисмнезия сопровождали судорожную активность у некоторых пациентов. Эта дифференциация может быть диагностически сложной, поскольку у пациентов с документально подтвержденными сложными частичными припадками височного происхождения могут быть сопутствующие неиктальные эпизодические эмоциональные симптомы, включая фобию, настоящие приступы паники и беспокойство.
Исследователи сравнили симптомы панического расстройства-агорафобии с симптомами сложных парциальных припадков. Из-за сходства они пришли к выводу, что оба этих расстройства могут иметь общий нейрофизиологический субстрат.
Распространенность аномальных ЭЭГ при агрессии варьирует в широких пределах: от 6,6% у пациентов с приступами ярости и эпизодическим насильственным поведением до 53% у пациентов с антисоциальным расстройством личности. Противосудорожные препараты могут блокировать эпилептиформные выделения ЭЭГ и могут приводить к значительному клиническому улучшению у лиц, проявляющих агрессивное поведение. Добавления карбамазепина для лечения пациентов с «насильственной шизофренией» с повторными агрессивными эпизодами, которые также демонстрируют нарушения в височной доле на ЭЭГ, но у которых в анамнезе нет судорожного расстройства. показали свою эффективность. Другие исследования показывают, что противосудорожная терапия может оказывать благотворное влияние на агрессивные тенденции независимо от наличия или отсутствия нарушений ЭЭГ.
Атипичное биполярное аффективное расстройство с быстрыми циклами
Исследователи сообщили о частоте в 7% определенных отклонений, свидетельствующих о судорожном расстройстве, и о дополнительных 19% умеренно патологических расстройствах дыхания, не являющихся диагностическими признаками судорожного расстройства у детей с СДВГ.
Пароксизмальные формы активности мозга это
а) Механизмы эпилептических припадков. Эпилептический разряд, являющийся основным электрофизиологическим проявлением эпилептического припадка, обычно состоит из ритмичных высокоамплитудных колебаний электрического потенциала. Как правило, его можно записать при ЭЭГ с кожи волосистой части головы, но в некоторых случаях он остается невыявленным даже при снятии ЭЭГ с поверхности головного мозга; это зависит от объема патологического очага, его геометрии и специфики активности (Bancaud и Talairach, 1975).
Это прямое указание на наличие патологической чрезмерной нейрональной активности, которую Hughlings Jackson постулировал как причину эпилепсии. Эпилептический разряд, записанный на коже головы или с поверхности коры, вызывается как патологической активностью отдельных нейронов, так и избыточной синхронизацией огромных клеточных популяций. Как схематически показано на рисунке ниже, пики на ЭЭГ отражают суммарные мембранные потенциалы, которые в свою очередь являются прямым следствием внутриклеточных процессов.
Самым ярким из них (при припадках фокальной природы) является выраженное увеличение площади мембранной деполяризации, вызываемое возбуждающими постсинаптическими потенциалами — пароксизмальный сдвиг мембранного потенциала. На межприступной ЭЭГ эти процессы соответствуют пикам у порогового уровня пораженных нейронов, за которыми следует длительная усиленная постполяризация. Во время припадка эта гиперполяризация исчезает, и повторные импульсы становятся неконтролируемыми. Это, в свою очередь, возбуждает соседние нейроны, которые начинают синхронно генерировать электрический разряд.
При генерализованных припадках могут действовать разные механизмы, но в случае судорожного припадка возникает длительная мембранная деполяризация. С другой стороны, при развитии неконвульсивных припадков, таких как абсансы, имеет место последовательность возбуждающих и тормозных потенциалов (Snead, 1995). Медленная волна на ЭЭГ, очевидно, отражает ГАМК-зависимое усиленное торможение, которое, во взаимодействии с повышенным возбуждением, способствует возникновению и поддержанию состояния эпилептической гиперсинхронии.
Низкопороговые кальциевые каналы в ретикулярных таламических нейронах — водителях ритма, вероятно, вызывают гиперсинхронные разряды типа спайк-волна при абсансной эпилепсии. Gloor и Fariello (1988) постулировали, что первичная генерализованная эпилепсия характеризуется диффузно гипервозбудимой корой, так что эпилептический разряд может запускаться при возбуждении таламической ретикулярной системы, которое вызывается входящим таламокортикальным импульсом; таким образом, для его возникновения необходимы и кора, и субкортикальные структуры.
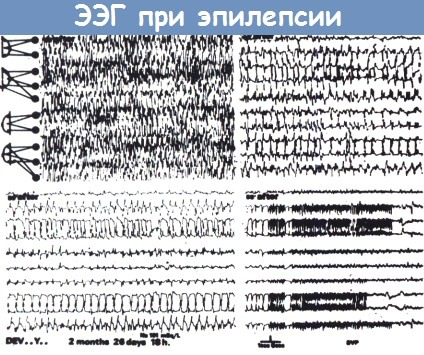
Тонический разряд (вверху слева), за которым следует клонический разряд (вверху справа, продолжение внизу слева).
Энцефалограмма, показанная внизу справа записана на медленной скорости и демонстрирует окончание припадка.
ЭЭГ-признаки этого припадка несколько атипичны, не одинаковы ритмы тонических разрядов правого и левого полушария.
Это часто встречается у детей; типичные генерализованные припадки у них наблюдаются редко.
Детальное описание механизмов, вызывающих эпилептический разряд, выходит за рамки настоящего руководства (для получения более подробной информации см. Jones, 2006; Najm et al., 2006b).
Повышенная возбудимость головного мозга может быть результатом генетически детерминированного химического дисбаланса между возбуждающими и тормозными нейромедиаторами, врожденных тонких изменений кортикальных нейрональных цепей или воздействия локального поражения. В этом отношении внимание исследователей привлекает возможное влияние нейронов, генерирующих патологические разряды на другие структуры головного мозга. При регулярно повторяющихся стимулах резко усиливается эффект фокальной субклинической стимуляции групп нейронов, что может привести к генерализованным припадкам (Moshe и Ludvig, 1988). Однако роль этого феномена «искры» в патогенезе эпилепсии у человека все еще не установлена, хотя этот процесс может быть фактором появления вторичных очагов (Morell, 1989).
Ослабленные механизмы торможения, как считается, играют важную роль в патогенезе эпилепсии; проводились широкие исследования основного кортикального тормозного нейромедиатора — гамма-аминомасляной кислоты (ГАМК). На основе гипотезы ГАМК разрабатываются основные терапевтические методики и антиэпилептические препараты.
В настоящее время исследования направлены на изучения таких возбуждающих нейромедиаторов, как глутамат и аспартат, избыток которых может вызывать локальное или генерализованное повышение кортикальной возбудимости (Naim et al., 2006b). Изменения рецепторов как возбуждающих (глутамат и аспартат), так и тормозных (ГАМК), вероятно, играют важную роль в регуляции кортикальной возбудимости, и различная скорость их «созревания» может объяснять различную предрасположенность к эпилепсии у разных возрастных групп (Moshe, 1987; Johnston, 1996; Holmes, 1997).
Вне зависимости от задействованных механизмов развитие головного мозга играет ключевую роль в предрасположенности к припадкам и их клинических проявлениях. В настоящее время активно изучаются морфологические, электрофизиологические и биохимические основы созревания головного мозга с точки зрения предрасположенности к припадкам (Jensen, 1999; Ben-Ari, 2006).
б) Причины пароксизмальных расстройств у детей. Симптоматические эпилептические припадки, как было сказано выше, могут вызываться большим количеством сопутствующих состояний, таких как высокая температура, гипогликемия, метаболический дисбаланс или острые заболевания. Почти всегда они проявляются как генерализованные судорожные припадки. Это может быть следствием таких состояний, как острое повреждение структур головного мозга вследствие травмы, метаболических расстройств или инфекций, которые могут поражать детей, не имеющих никакой предрасположенности к припадкам. Однако чаще все же имеется специфическая предрасположенность к припадкам, в основном, вероятно, генетического происхождения, и часто зависящая от возраста, и определяющая индивидуальную чувствительность к действию специфических стимулов; наиболее частым примером являются фебрильные судороги.
Тем не менее, с точки зрения этиологии нельзя противопоставлять эти две группы симптоматических припадков. Структурные нарушения гораздо чаще вызывают судороги у пациентов с наличием в семейном анамнезе случаев эпилепсии, среди населения в целом, то же самое относится и к другим причинам, например, острому менингиту.
Эпилепсия (как хроническое заболевание) также может вызываться только генетическими факторами или хроническим поражением головного мозга (врожденным или приобретенным) или различными комбинациями этих факторов (Berkovic et al., 1987).
Эпилепсии обычно подразделяют на идиопатические, симптоматические и криптогенные. При идиопатических эпилепсиях не удается обнаружить поражение или патологию головного мозга; симптоматические эпилепсии развиваются вследствие какой-либо патологии или приобретенного поражения; криптогенные эпилепсии — это те, при которых вероятно наличие органической причины, обнаружить которую, однако же, не удается. С развитием методов исследования последняя категория встречается все реже.
Генетические факторы играют важнейшую роль при эпилепсии, не связанной с неврологическими расстройствами (идиопатические эпилепсии), но также могут иметь значение при эпилепсии, связанной с выявленными повреждениями головного мозга (Ottman, 1989, 2005).
Их роль и тип наследования варьируют в зависимости от типа эпилепсии; далее в таблице ниже приведены данные по генетике каждого эпилептического синдрома. За последние 20 лет было установлено, что некоторые генетические синдромы имеют монофакториальное происхождение; в настоящее время бурно развивается молекулярная генетика эпилепсии у детей (подробнее см. Battaglia и Guerrini, 2005; Duron et al., 2005; Gardiner, 2005; Heron et al., 2007). Только небольшое количество случаев (1-2%) может быть отнесено к однолокусным аномалиям, таким, как туберозный склероз или к метаболическим нарушениям. Эпилептический синдром с моногенным доминантным типом наследования, описанный ниже, включает в себя доброкачественные неонатальные конвульсии (Leppert et al., 1989), доброкачественные инфантильные судороги (Vigevano et al., 1992; Fxhenne et al., 1994), семейный лобный (Scheffer et al., 1995a), медиальный и латеральный (Berkovic et al., 1996; Andermann и Kobayashi, 2005), височно-долевой эпилептические синдромы.
Действие генетических факторов не ограничивается этими относительно редкими случаями. Было выявлено несколько генов, участвующих в развитии немоногенных форм эпилепсии. Гораздо чаще встречается комплексное наследование (Turnbull et al., 2005), хотя для эпилепсий с 3 Гц спайк-волновой активностью и, возможно, некоторых форм фотосенситивной эпилепсии предполагается доминантный механизм наследования (Doose и Waltz, 1993). Doose и Baier (1987) предположили, что определенные ЭЭГ-признаки (например, фоточувствительность или спонтанные пароксизмы спайк-волн) могут наследоваться независимо, и что комбинация таких ЭЭГ-признаков (возможно, и других факторов) может указывать на наследственную предрасположенность к различным формам эпилепсии.
Считалось, что некоторые синдромы, для которых был определен доминантный ген, например, ювенильная миоклоническая эпилепсия, наследуются по доминантному типу, однако в настоящее время выявлено, что эти состояния наследуются по комплексному (многофакторному) механизму (Greenberg et al., 1988), и в наследовании участвуют несколько других генов.
В настоящее время считается, что многие гены наследования эпилепсии—это гены предрасположенности, чье сочетанное действие и дополнительные факторы среды увеличивают вероятность возникновения клинической эпилепсии; это объясняет тот факт, что сиблинги/родители больных могут не страдать эпилепсией или иметь другие формы эпилептического синдрома.
Повреждение головного мозга является основным этиологическим фактором парциальной или генерализованной эпилепсии, сочетающейся с клиническими проявлениями дефектов развития нервной системы. Причины включают в себя опухоли головного мозга, травмы, нарушения развития коры, туберозный склероз, поражения, связанные с синдромом Штурге-Вебера, склероз гиппокампа и сосудистые аномалии. Основные этиологические факторы поражений головного мозга, сочетающихся с эпилепсией, перечислены в таблице ниже.
Определение симптоматическая или «связанная с поражением головного мозга» используется в случаях, когда поражение вызывает клинические нарушения или выраженные изменения, выявляемые при визуализации и/или когнитивные нарушения. Микроскопические изменения, при жизни обычно не выявляемые, также играют важную, хотя и не определенную до сих пор роль в патогенезе эпилепсии (так называемые криптогенные эпилепсии). С помощью современных методов нейровизуализации было выявлено, что многие случаи криптогенной эпилепсии на самом деле вызваны внутричерепным патологическим процессом (подробнее см. Arzimanoglou et al., 2004). Патология развития коры наиболее вероятная причина так называемых криптогенных фокальных эпилепсий.
Однако механизм развития эпилепсии при наличии повреждения, и такие феномены, как период латентности между поражением и началом припадков, все еще не совсем понятны.
Эпилепсия также является частым проявлением таких хромосомных расстройств, как синдром Ангельмана, синдром Дауна, трисомия 12p, кольцевые хромосомы 14 и 20, синдром ломкой Х-хромосомы, синдром del 1p36 (синдром делеции короткого плеча 1 хромосомы — прим, перге.) (Battaglia и Guerrini, 2005), и также может быть связана с врожденными нарушениями метаболизма (Wolf et al., 2005).
Редактор: Искандер Милевски. Дата публикации: 3.1.2019
Признаки пароксизмальной активности
Человеческий мозг созревает постепенно. К 21 году жизни структуры мозга полностью формируются. Зрелость коры больших полушарий и подкорки выявляется на электроэнцефалографии – методе снятия биоэлектрических импульсов, которые возникают при электрической деятельности головного мозга. В норме у здорового человека все волны на ЭЭГ правильного ритма и амплитуды.
Если мозг незрелый или человек страдает психическими и неврологическими заболеваниями, изменяются качественные и количественные показатели волн на электроэнцефалографии. Одно из таких проявлений – пароксизмальная активность.
Что это такое
Пароксизмальная активность – это величина, которая регистрируется на электроэнцефалограмме. Пароксизмальная деятельность мозга – это изменение нормальной волны, и проявляется пиками, остроконечными волнами, патологическими комплексами и замедлением электрической активности мозга.
В широком смысле пароксизмальная активность – это неправильная электрическая деятельность головного мозга.
Очаг пароксизмальной активности возникает при многих патологических состояниях человека:
Когда регистрируется пароксизмальная активность, врачи подразумевают под этим явление, при котором процессы возбуждения в коре и подкорке сильно преобладают над процессами торможения. Признаки пароксизмальной активности: внезапное начало, скоротечность, внезапное окончание и склонность к рецидивам.
На электроэнцефалограмме пароксизмальная деятельность головного мозга проявляется как ряд волн, амплитуда которых быстро стремится к пику. Пароксизмальная активность охватывает ритмы ЭЭГ: альфа, бета, дельта и тета-ритмы.
Для изучения нюансов врачи сравнивают остроконечные волны с нормальными. Рассматриваются фундаментальные показатели активности: базовая активность, симметричность, ритмичность, амплитуда. Также регистрируют изменения деятельности при стимуляции мозга: световое или звуковое раздражение, состояние гипервентиляции, открытие или закрытие глаз.
Классификация пароксизмального заболевания на изменениях типов волн на электроэнцефалограмме.
Альфа-ритм. Его нормальная частота – от 8 до 13 Гц, амплитуда достигает 100 мкВ. Пароксизмальная активность головного у детей при альфа-ритме говорит о таких вероятных патологиях:
Бета-ритм. В норме его амплитуда – от 3 до 5 мкВ, частота – от 14 до 30 Гц. Локальная и пароксизмальная патологическая активность возникает, когда частота достигает 50 мкВ. Она регистрируется при задержке психомоторного развития у ребенка.
Дельта- и тета-ритмы. Пароксизмальная активность головного мозга у взрослого регистрируется при хронических атрофических и дистрофических изменениях коры и подкорковых структур. Чаще всего это связано с дисциркуляторной энцефалопатией, опухолями, гипертензивным синдромом, глубоким приобретенным слабоумием. В пользу деменции говорит билатерально синхронная пароксизмальная активность.
Наиболее отчетливая пароксизмальная деятельность отмечается при эпилепсии. Пароксизмальная активность на ЭЭГ у ребенка при доброкачественном течение выявляется центральными и темпоральными спайк-волнами, очаговыми разрядами с острыми волнами преимущественно в области височной коры.
По типу патологической деятельности можно судить о виде эпилепсии. Для детской эпилепсии с абсансами характерны билатеральные синхронные волны с частотой спайковых волн в 3 Гц. Длительность активности – до 10 секунд за один эпизод. Приступ начинается с частоты 3 Гц, в дальше ритм замедляется. Для юношеской абсанс эпилепсии характерны полиспайки, частота которых выше 3 Гц.
Для синдрома Ландау-Клеффнера характерны острые и медленные волны в проекции височной коры. Они бисинхронные и многоочаговые. При прогрессировании заболевания возникает электрический статус медленного сна. Для него характерны непрерывные спайк-волны, которые активируются во время фазы сна – быстрого движения глаз.
Прогрессирующие эпилепсии с миоклонусами отличаются генерализованнымы спайковыми волнами, потенцированными амплитудами, нарушением ритмов волн.
Когда наблюдается гиперсинхронность всех волн на ЭЭГ – это снижение порога пароксизмальной активности. Обычно при гиперсинхронности сильно повышается амплитуда, а волна приобретает заостренный пик. Если порог пароксизмальной активности снижен, снижается порог судорожной активности мозга. Это значит, чтобы возник судорожный припадок, нужен масштабный пароксизмальный очаг в головном мозгу, то есть легкая пароксизмальная активность коры головного мозга не спровоцирует припадок и сработает противосудорожная система мозга. Низкий порог говорит об эффективном противоэпилептическом лечении.
Терапия
Пароксизмальная активность – это не мишень терапии. Первоначально устраняется причина, вызвавшая неправильную работу головного мозга. Используются такие принципы лечения:
Когда эти три вида лечения назначаются и есть эффект, пароксизмальная активность головного мозга устраняется сама по себе.
Пароксизмальные формы активности мозга это
Клиническая картина церебральных пароксизмов как эпилептического, так и неэпилептического генеза отличается многообразием проявлений, что приводит порой к диагностическим ошибкам и назначению неадекватной терапии. Следует помнить, что гипердиагностика эпилепсии в перспективе может причинять не меньше вреда пациенту, чем пропущенные случаи. Большинства диагностических ошибок можно избежать благодаря тщательному и подробному сбору анамнестических сведений, грамотному подходу к наблюдению пациента и адекватной оценке инструментальных методов обследования. Описываемый нами случай демонстрирует полиморфизм пароксизмальных состояний в детском возрасте.
Клинический случай
Пациентка В., поступила в неврологическое отделение 3-й ГДКБ Минска в возрасте 1 год 6 месяцев с жалобами на эпизодическое «закатывание» глаз в сторону в течение нескольких секунд, при этом в момент реализации данного пароксизма у ребенка отсутствовала реакция на обращение и звуковые раздражители. Подобные состояния отмечались мамой девочки в течение недели до момента поступления в стационар. Заболевание началось с 2-х эпизодов в течение суток, затем количество пароксизмов увеличилось до 10–15 раз. Предшествующее заболеванию травматическое повреждение центральной нервной системы мамой отрицалось; ранее у ребенка в анамнезе также не отмечалось черепно-мозговых травм, нарушений сознания либо пароксизмальных состояний эпилептического и неэпилептического генеза.
Из анамнеза: ребенок от 2-й беременности, первых срочных родов. Родоразрешение было осуществлено путем вакуум-экстракции в сроке 41 неделя гестации. Беременность протекала на фоне угрозы прерывания по причине ОРВИ в 1-м и 2-м триместрах. Вес при рождении составлял 3 810 г, длина 51 см. Вскармливание искусственное. Развитие ребенка до госпитализации соответствовало возрастной норме, прививки выполнены. За предшествующий период ребенок переносил только простудные заболевания. Хроническую соматическую патологию и оперативные вмешательства мама отрицала. Наследственность и трансфузионный анамнез не отягощены, однако у девочки наличествовала аллергологическая патология (пищевая аллергия на белок коровьего молока).
При поступлении соматический статус без особенностей. Физическое развитие среднее дисгармоничное по весу. Неврологический статус: девочка в сознании, эмоционально лабильна, в поведении адекватна, доступна осмотру и соответствующему возрасту контакту. Сон, со слов матери, спокойный. Со стороны черепных нервов отмечалась легкая асимметрия носогубных складок. Верхние конечности: объем движений и мышечный тонус физиологический. Мышечная сила соответствует возрасту. Трофика мышц без особенностей. Гиперкинезов нет. СПР D=S, оживлены, рефлексогенные зоны не расширены. Брюшные рефлексы D=S, средней живости. Нижние конечности: объем движений физиологический. Мышечная сила соответствует возрасту. Трофика мышц без особенностей. Мышечный тонус ближе к физиологическому, слегка повышен. Гиперкинезов нет. Рефлексы коленные D=S, ахилловы D=S. Патологических стопных знаков нет. Координаторная сфера без особенностей. Ходит самостоятельно с 1 года 1 месяца, несколько ротирует внутрь правую стопу, опора с тенденцией на передний отдел стоп (эпизодическая доброкачественная дистоническая реакция опоры на стопу). Менингеальных симптомов нет. Тазовые органы без патологии.
На вторые сутки пребывания в отделении количество эпизодов отведения глаз в сторону составило порядка 10. Длительность эпизодов колебалась от 5–10 секунд до нескольких минут. Эпизодам отведения глаз сопутствовало расстройство координации легкой степени выраженности, которое исчезало через 5–10 минут после окончания окуломоторного пароксизма.
Выставлен предварительный диагноз: пароксизмальные состояния с наличием эпизодов тонического отведения глаз в сторону неуточненного генеза.
До проведения обследования с целью снижения возбудимости центральной нервной системы ребенку назначен громецин в дозе 0,1 г по 1 таблетке 2 раза в день.
Проведенное электроэнцефалографическое (ЭЭГ) обследование выявило легкие диффузные изменения с признаками нейрофизиологической незрелости. Пароксизмальной активности не зарегистрировано (см. рис. 1). Общий и биохимический анализы крови без патологии.
Рисунок 1. Первичное ЭЭГ-обследование. Легкие диффузные изменения с признаками нейрофизиологической незрелости. При проведении нейровизуализационного исследования (МРТ 2 Тл) выявлены признаки некоторого усиления МР-сигнала в парагиппокампальной области (см. рис. 2а) и незначительного расширения переднего субарахноидального пространства (см. рис. 2б), что может свидетельствовать в пользу перенесенной гипоксически-ишемической перинатальной энцефалопат На третьи сутки количество эпизодов отведения глаз сократилось до 6, при этом их продолжительность не превышала нескольких секунд.
Рисунок 2а. МРТ-исследование. Признаки усиления МР-сигнала в парагиппокампальной области.
Рисунок 2б. МРТ-исследование. Признаки незначительного расширения переднего субарахноидального пространства. На четвертые сутки количество пароксизмов продолжило уменьшаться и составило всего 2 эпизода длительностью 1–2 секунды. При этом ранее сопутствовавших данным состояниям нарушений координации не отмечалось.
На пятые сутки эпизоды отведения глаз полностью прекратились и в последующие дни пребывания в стационаре не повторялись.
Повторные ЭЭГ-обследования, проведенные на третьи и шестые (см. рис. 3а, 3б) сутки от момента госпитализации, региональных и патологических форм биоэлектрической активности не выявили.
Исследование крови на вирусы, бактерии и простейшие не позволило выявить значимого инфекционного фактора в развитии текущего заболевания.
Рисунок 3а. Повторное ЭЭГ-обследование. Легкие диффузные изменения биоэлектрической активности головного мозга. Региональных и патологических форм активности не выявлено.
Рисунок 3б. Повторное ЭЭГ-обследование. Легкие диффузные изменения биоэлектрической активности головного мозга. Региональных и патологических форм активности не выявлено.
Окончательный диагноз: пароксизмальные состояния по типу доброкачественных эпизодов тонического отведения глаз в сторону неэпилептического генеза.
Противоэпилептическая терапия не назначалась. Ребенок выписан домой в удовлетворительном состоянии.
При контрольном осмотре через 2 месяца после выписки из стационара было установлено, что пароксизмальные состояния не повторялись, неврологический статус сохранялся прежним. Девочка продвинулась в психоречевом развитии: увеличился активный и пассивный словарный запас, стала говорить предложениями из двух слов. ЭЭГ-обследование существенных изменений не выявило.
Комментарий
Доброкачественные тонические отведения глаз в сторону у детей — это гетерогенная группа состояний с пролонгированными эпизодами постоянных или преходящих девиаций глазных яблок в противоположное желаемому направление с быстрым возвратом в исходное положение.
Этиология описываемого пароксизмального состояния неоднородна, а патогенез до настоящего времени остается до конца не установленным. По результатам исследований некоторых авторов, заболевание может иметь аутосомно-рецессивную и аутосомно-доминантную природу наследования. У таких пациентов могут выявляться мутации в гене кальциевого канала CACNA1A. Нельзя исключить вариант функционального генеза доброкачественного тонического отведения глаз в сторону вследствие незрелости мозговых структур и нарушения межнейронной коммуникации.
Наиболее часто исследователями рассматривается гипотеза возраст-зависимой дисфункции супрануклеарных путей. Этиологическими факторами симптоматических форм заболевания могут служить повреждения мезенцефальной области — мальформация вены Галена, пинеалома, гидроцефалия, опухоль гипофиза. Возможна также ятрогенная природа данного пароксизмального состояния. Ряд авторов указывает на более частое его развитие у тех детей, матери которых во время беременности принимали препараты вальпроевой кислоты.
Клинические проявления доброкачественного тонического отведения глаз в сторону отличаются некоторым разнообразием. Дебют заболевания, как правило, возникает в возрасте 4–10 месяцев. В наиболее крупном исследовании данной патологии возраст дебюта варьировал от 1 недели до 26 месяцев жизни (в среднем 5,5 месяца). Частота приступов вариабельна в течение суток от единичных до ежечасных. Характерно учащение и усиление выраженности пароксизмов при инфекционных заболеваниях, сопровождающихся лихорадкой, а также при физическом и психоэмоциональном переутомлении. Как правило, в течение всего периода заболевания модификации вида пароксизмов не происходит. Считается, что продолжительность заболевания и срок достижения ремиссии (спонтанного исчезновения отведения глаз) в среднем могут варьировать от нескольких дней до 5 лет.
При доброкачественных тонических отведениях глаз в сторону и вверх у ряда детей отмечаются эпизоды дополнительного наклона подбородка вниз, однако ряд авторов полагает, что это компенсаторный механизм с целью коррекции неправильной позиции глазных яблок. При существующем стереотипе отведения глаз в определенном направлении противоположное движение обычно не изменено. Тем не менее, у части пациентов во время пароксизма может иметь место однонаправленный нистагм с быстрым компонентом в обратную сторону.
Кроме того, некоторыми исследователями описаны гипометрические саккады и расходящееся косоглазие, которые могут сохраняться в течение некоторого времени (в отдельных случаях — длительно) после прекращения тонических отведений глаз.
Описываемое неэпилептическое пароксизмальное состояние периодически сопровождается моторной неловкостью и атаксией различной степени выраженности, продолжительностью от нескольких часов до нескольких дней. Координаторная дисфункция легкой степени выраженности также может иметь тенденцию к сохранению после разрешения основного заболевания.
По данным различных авторов, около 50 % детей с доброкачественным тоническим отведением глаз в сторону имеют нормальное психическое развитие, приблизительно 40 % — легкий интеллектуальный дефицит, 10 % — нарушения интеллекта от умеренной до выраженной степени. В подавляющем большинстве случаев нормальный психоневрологический статус у пациентов с описываемым вариантом пароксизмов коррелирует со спонтанной ремиссией в течение 2 лет от начала заболевания. Если же имеет место сочетание данного состояния и неврологического и/или когнитивно-мнестического дефицита, то необходимо дополнительное обследование ребенка на предмет симптоматической природы этиологии патологического процесса.
Инструментально-диагностические и лабораторные исследования чаще всего демонстрируют нормальные показатели нейровизуализации, электроэнцефалографии и метаболических параметров крови и ликвора у детей с идиопатическими (генетическими) формами заболевания. Золотой стандарт нейровизуализационного обследования — МРТ головного мозга, как правило, не выявляет патологических изменений.
Дифференциальный диагноз доброкачественных тонических отведений глаз в сторону проводят с эпилептическими пароксизмальными состояниями, в частности с окуломоторными приступами и атипичными абсансами.
Специфическое лечение данного состояния не разработано, попытки терапевтического воздействия чаще всего оказываются неэффективными. По данным наиболее крупного исследования, терапия антиконвульсантами, ацетазоламидом и адренокортикотропным гормоном не оказала влияния на течение заболевания. Тем не менее ряд авторов указывает на достижение положительного эффекта в отношении частоты и выраженности пароксизмов при применении дигидроксифенилаланина (леводопы).